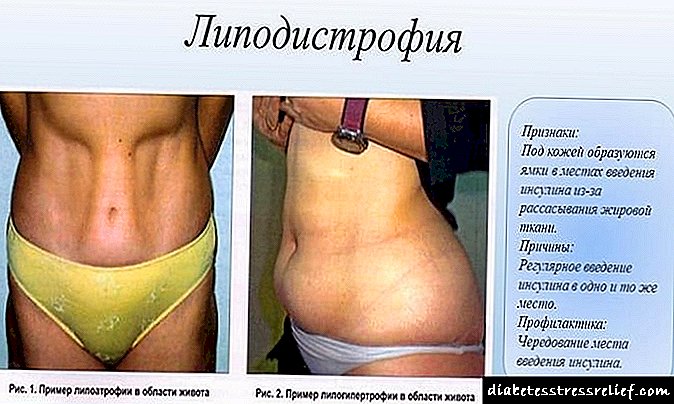
Холестерин биосинтезі және оның биохимиясы - Диабет
Холестериннің көпшілікке әйгілі липид болып табылатындығына күмән жоқ, өйткені бұл жоғары қан холестерині мен адамның жүрек-қан тамырлары ауруларының жиілігі арасындағы байланысты. Холестериннің жасуша мембраналарының құрамдас бөлігі және стероидты гормондар мен өт қышқылдарының құрамдас бөлігі ретіндегі маңызды рөліне аз көңіл бөлінді. Холестерин көптеген жануарларға, соның ішінде адамдарға қажет, бірақ оның сүтқоректілердің құрамында болуы міндетті емес - дене жасушалары өздері оны қарапайым прекурсорлардан синтездей алады.
Бұл 27-көміртекті қосылыстың құрылымы оның биосинтезінің күрделі жолын ұсынады, бірақ оның барлық көміртегі атомдары жалғыз прекурсор - ацетатпен қамтамасыз етіледі. Изопрен блоктары - Ацетаттан холестеринге дейінгі маңызды делдалдар, олар көптеген табиғи липидтердің алғышарттары және изопрен блоктары полимерленетін механизмдер барлық метаболикалық жолдарда ұқсас.
Біз ацетаттан холестерин биосинтезі жолындағы негізгі кезеңдерді қарастырудан бастаймыз, содан кейін холестеринді қан ағымы арқылы тасымалдау, оның жасушалар арқылы сіңуі, холестерин синтезінің қалыпты реттелуі және сіңірілу немесе тасымалдау жағдайындағы реттеу туралы талқылаймыз. Содан кейін біз холестериннен пайда болатын басқа заттарды, мысалы, өт қышқылдары мен стероидты гормондарды қарастырамыз. Соңында, көптеген қосылыстардың - изопрен блоктарының туындылары, холестерин синтезі бар жалпы ерте сатылардың пайда болуының биосинтетикалық жолдарының сипаттамасы биосинтездегі изопреноидты конденсацияның ерекше әмбебаптығын көрсетеді.
Холестерол ацетил-КоА-дан төрт сатыда шығарылады
Холестерин, ұзын тізбекті май қышқылдары сияқты, ацетил-КоА-дан жасалған, бірақ құрастыру үлгісі мүлдем басқаша. Алғашқы тәжірибелерде 14 С белгіленген эфир метилінде немесе карбоксилді көміртек атомында жануарлардың жеміне қосылды. Екі топтық жануарлардан оқшауланған холестеринге затбелгі бөлінуі негізінде (21-32-сурет), холестерин биосинтезінің ферментативті кезеңдері сипатталды.
Сур. 21-32. Холестериннің көміртегі атомдарының көзі. Метил көміртегі (қара) немесе карбоксилді көміртегі (қызыл) деп белгіленген радиоактивті ацетатты қолдану арқылы тәжірибе барысында анықталды. Конденсацияланған құрылымда сақиналар А-дан Д әріптерімен белгіленеді.

Синтез, суретте көрсетілгендей, төрт сатыда жүреді. 21-33: (1) үш ацетат қалдықтарының конденсациясы алты көміртекті мевалонат аралықты құрайды, (2) мевалонатаның активтендірілген изопрен блоктарына айналуы, (3) 30 көміртекті сызықты скваленаны құру үшін алты бес көміртекті изопрен бірлігінің полимерленуі, (4) скалалиннің циклденуі. стероидты ядроның төрт сақинасы, содан кейін холестериннің пайда болуымен бірқатар өзгерістер (тотығу, метил тобының жойылуы немесе қоныс аударуы).
Сур. 21-33. Холестерин биосинтезінің жалпыланған суреті. Мәтінде синтездің төрт кезеңі қарастырылады. Сквалендегі изопрен блоктары қызыл түсті сызықтармен белгіленген.

Кезең (1). Ацетаттан мевалонат синтезі. Холестерин биосинтезінің бірінші кезеңі аралық өнімнің пайда болуына әкеледі мевалонат (Cурет 21-34). Екі ацетил КоА молекуласы ацетоацетил КоА-ны береді, ал үшінші ацетил КоА молекуласымен алты көміртекті қосылыс түзеді β-гидрокси-β-метилглютарил-CoA (HM G -CoA). Бұл алғашқы екі реакция катализденеді тиолаза сәйкесінше NM G -CoA синтазасы. Цитозолдық NM G-CoA синтезі Бұл метаболизм жолы кетон денелерінің қалыптасуы кезінде NM G -CoA синтезін катализдейтін митохондриялық изоэнзимнен ерекшеленеді (17-18 суретті қараңыз).
Сур. 21-34. Ацетил-КоА-дан мевалонатаның түзілуі. Ацетил-КоА-дан алынған C-1 және C-2 mevalonate көзі қызғылт түспен ерекшеленеді.

Үшінші реакция бүкіл процестің жылдамдығын шектейді. Онда NM G -CoA мевалонатқа дейін азаяды, ол үшін NA D PH екі молекуласының әрқайсысы екі электронды қамтамасыз етеді. HMG-CoA редуктазы - тегіс ER-дің интегралды мембраналық ақуызы, ол кейінірек көретініміздей, холестерин түзілуінің метаболикалық жолын реттеудің негізгі нүктесі ретінде қызмет етеді.
Кезең (2). Мевалонатты екі активтендірілген изопренаға түрлендіру. Холестерин синтезінің келесі сатысында АТФ молекулаларынан үш фосфат тобы мевалонатқа өтеді (21-35-сурет). Аралық 3-фосфо-5-пирофосфомевалонаттағы С-3 мевалонатында гидроксил тобына қосылған фосфат жақсы кетеді, келесі сатыда осы фосфаттардың екеуі де, көршілес карбоксил тобымен де кетіп, бес көміртекті өнімде қос байланыс түзеді - - 3 -изопентенил пирофосфаты. Бұл екі белсенді изопреннің біріншісі - холестерин синтезінің негізгі қатысушылары. Δ 3 -исопентенилпирофосфаттың изомеризациясы екінші активтендірілген изопренаны береді диметилалил пирофосфаты. Өсімдік жасушаларының цитоплазмасындағы изопентенил пирофосфатының синтезі осында сипатталған жолға сәйкес жүреді. Алайда өсімдік хлоропласттары мен көптеген бактериялар мевалонатқа тәуелсіз жолды пайдаланады. Бұл балама жол жануарларда кездеспейді, сондықтан жаңа антибиотиктер жасағанда тартымды болады.
Сур. 21-35. Мевалонатты активтендірілген изопрена блоктарына түрлендіру. Іске қосылған алты блок скваленаны құрайды (21-36 суретті қараңыз). 3-фосфо-5-пирофосфомваланаттың қалған топтары қызғылт түспен ерекшеленеді. Шаршы жақшада гипотетикалық аралық орналасқан.

Кезең (3). Скалалин түзетін алты изопрен қондырғысының конденсациясы. Изопентенил пирофосфаты және диметилилилді пирофосфат қазір құйрықты конденсацияға ұшырайды, онда бір пирофосфат тобы қозғалады және 10 көміртегі тізбегі пайда болады - геранилді пирофосфат (21-36-сурет). (Пирофосфат басына жабысады.) Геранил пирофосфаты изопентенил пирофосфатымен және 15 көміртекті аралық нысандармен келесі құйрықты конденсацияға ұшырайды. фарнезил пирофосфаты. Сонымен, фарнезил пирофосфатының екі молекуласы «басынан басталады», екі фосфат тобы да жойылады сквален.
Сур. 21-36. Скваленнің түзілуі. 30 көміртегі атомынан тұратын сквален құрылымы изопрен (бес көміртекті) блоктарымен іске қосылған кезекті конденсация кезінде пайда болады.

Бұл делдалдардың ортақ есімдері олар алғаш оқшауланған көздердің аттарынан пайда болады. Раушан майының құрамдас бөлігі гераниол, герань хош иісіне ие, ал акация фарнессінің түстерінде орналасқан фарнессол, алқаптың хош иісі лалагүліне ие. Өсімдіктердің көптеген табиғи иістері изопрен блоктарынан алынған қосылыстарға жатады. Алғашқыда акулалық бауырдан оқшауланған сквалена (Squalus түрлері) 30 көміртегі атомынан тұрады: негізгі тізбектегі 24 атом және металл алмастырғыштарда алты атом.
Кезең (4). Скваленнің стероидты ядроның төрт сақинасына айналуы. Суретте. 21-37 анықталғандай, сквален тізбегінің құрылымы, ал стеролдар - циклді. Барлық стеролдарда стероидты ядроны құрайтын төрт конденсацияланған сақина бар және олардың барлығы С-3 атомындағы гидроксил тобы бар алкогольдер, демек, ағылшынның атауы - стерол. Әрекет етуде скалалин монооксигенасы О-дан бір оттегі атомы скалалин тізбегінің соңына қосылады 2 және эпоксид пайда болады. Бұл фермент тағы бір аралас функциялы оксидаза болып табылады (қосу 21-1), NADPH О-дан басқа оттегі атомын азайтады 2 дейін Н2 О. Өнімнің қос байланысы сквален-2,3-эпоксид керемет дәйекті реакция скалалин эпоксидінің тізбегін циклдік құрылымға айналдыра алатын етіп орналастырылған. Жануарлардың жасушаларында бұл циклизация түзілуіне әкеледі ланостерол стероидтық ядроға тән төрт сақинадан тұрады. Нәтижесінде ланостерол шамамен 20 реакция сериясы арқылы холестеринге айналады, оның құрамына кейбір металл топтарының көші-қоны және басқаларын алып тастау кіреді. Биосинтездің осы таңғажайып жолын сипаттау ең танымалдардың бірі - Конрад Блох, Теодор Линен, Джон Корнфорт және Джордж Попиак 1950 жылдардың соңында жасаған.
Сур. 21-37. Сақинаны жабу сызықты скваленді конденсацияланған стероид ядросына айналдырады. Бірінші кезең - аралас функциясы бар оксидазамен (монооксигеназа) катализденеді, оның косубстраты N AD PH болып табылады. Өнім - бұл эпоксид, келесі сатыда стероидтық өзек түзіледі. Бұл реакциялардың жануарлар клеткаларындағы соңғы өнімі холестерин болып табылады, басқа организмдерде одан сәл өзгеше стеролдар түзіледі.


Холестерол - бұл жануарлар жасушаларына, өсімдіктерге, саңырауқұлақтар мен протисттерге тән стерол, басқа да ұқсас стеролдар шығарады.
Олар скалален-2,3-эпоксид үшін бірдей синтез жолын қолданады, бірақ содан кейін жолдар аздап бөлінеді, ал басқа стеролдар пайда болады, мысалы көптеген өсімдіктерде сигмастерол және саңырауқұлақтардағы эргостерол (сур. 21-37).
Мысал 21-1 Сквален синтезінің энергия шығындары
Бір сквален молекуласын синтездеуге қандай энергия шығындары (ATP молекулалары түрінде көрсетіледі)?
Шешімі. Ацетил-КоА-дан алынған скалинді синтезде АТФ тек мевалонат активтендірілген изопрен скваленінің прекурсорына айналған кезде жұмсалады. Скалален молекуласын құру үшін алты белсенді изопрен молекуласы, ал әрбір активтенген молекуланы шығару үшін үш ATP молекуласы қажет. Жалпы, бір сквален молекуласының синтезіне 18 АТФ молекуласы жұмсалады.
Денедегі холестериннің қосылыстары
Омыртқалыларда холестериннің көп мөлшері бауырда синтезделеді. Онда синтезделген холестериннің бір бөлігі гепатоциттердің мембраналарына енеді, бірақ ол негізінен оның үш формасының біріне экспортталады: өт (өт) холестерол, өт қышқылы немесе холестерол эфирлері. Өт қышқылдары және олардың тұздары - холестериннің гидрофильді туындылары, олар бауырда синтезделіп, липидтердің қорытылуына ықпал етеді (17-1 суретті қараңыз). Холестеринді бағалау әрекетте бауырда қалыптасады ацил-КоА-холестерин-ацилтрансфераза (ACAT). Бұл фермент май қышқылының қалдықтарын А коэнзимінен холестериннің гидроксил тобына ауыстыруды катализдейді (21-38-сурет), холестеринді неғұрлым гидрофобты түрге айналдырады. Липопротеиннің бөлінген бөлшектеріндегі холестерин эфирлері холестеринді қолданып басқа бауырға тасымалданады немесе бауырда сақталады.
Сур. 21-38. Холестерол эфирлерін синтездеу. Этерификация холестеринді сақтау мен тасымалдау үшін одан да көп гидрофобты түрге айналдырады.

Холестерин өсіп келе жатқан жануарлар ағзасының барлық ұлпаларына мембраналарды синтездеу үшін қажет, ал кейбір органдар (мысалы, бүйрек үсті бездері және жыныс бездері) холестеринді стероидты гормондарға алдын-ала қолданады (мұны төменде қарастырамыз). Холестерол сонымен қатар D дәрумені үшін алдын ала әсер етеді (10-20 суретті қара, 1-суретті қараңыз).
Холестерин және басқа липидтер плазмалық липопротеидтерді тасымалдайды
Триацилглицеролдар мен фосфолипидтер сияқты холестерин мен холестерол эфирлері суда ерімейді, бірақ олар синтезделген тіннен олар сақталатын немесе тұтынылатын тіндерге ауысуы керек. Оларды қан түрінде жүзеге асырады қан плазмасындағы липопротеидтер - нақты тасымалдаушы ақуыздардың макромолекулалық кешендері (аполипопротеидтер) фосфолипидтермен, холестеринмен, холестеринді эфирлермен және триацилглицеролдармен осы комплекстерде әртүрлі комбинацияларда болады.
Аполипопротеидтер («апо» липидсіз ақуыздың өзіне жатады) липидтермен біріктіріліп, липопротеин бөлшектерінің бірнеше фракциясын - ортасында гидрофобты липидтері бар сфералық комплекстерді және бетіндегі гидрофильді аминқышқылдарының тізбегін құрайды (21-39-сурет, а). Липидтер мен ақуыздардың әртүрлі комбинацияларында әртүрлі тығыздықтағы бөлшектер пайда болады - хломицрондардан жоғары тығыздықтағы липопротеидтерге дейін. Бұл бөлшектерді ультрацентрифугалаумен бөлуге болады (кесте 21-1) және электронды микроскопия көмегімен көзбен байқауға болады (21-39, б-сурет). Липопротеиндердің әр фракциясы белгілі бір функцияны орындайды, ол синтезделетін орны, липидтердің құрамы және аполипопротеидтердің құрамымен анықталады. Адамның қан плазмасында кем дегенде 10 түрлі аполипопротеидтер табылды (21-2 кесте), олар мөлшері әр түрлі, нақты антиденелермен реакциясы және липопротеиндердің әр түрлі кластарына тән таралуы. Бұл ақуыз компоненттері липопротеиндерді белгілі бір тіндерге бағыттайтын немесе липопротеидтерге әсер ететін ферменттерді белсендіретін ферменттер ретінде әрекет етеді.
21-1 кесте. Адамның плазмалық липопротеидтері
Құрамы (үлес салмағы,%)
r = 513,000). LDL бөлшектерінде шамамен 1500 молекулалық холестерин эфирінің ядросы болады, оның ядросының айналасында 500 молекулалық холестерин қабығы, 800 молекулалық фосфолипидтер және бір апоБ-100 молекуласы болады. b - электронды микроскоппен көрінетін липопротеидтердің төрт класы (теріс көріністен кейін). Сағат тілімен, сол жақ жоғарғы суреттен бастап: хломицрондар - диаметрі 50-ден 200 нм-ге дейін, PL O NP - 28-ден 70 нм-ге, HDL - 8-ден 11 нм-ге дейін, ал LDL - 20-дан 55 нм-ге дейін. Липопротеидтердің қасиеттері кестеде келтірілген. 21-2.

Chylomicrons, сек. 17, тағамдық триацилглицеролдарды ішектен басқа ұлпаларға ауыстырыңыз. Бұл ең үлкен липопротеидтер, олардың тығыздығы ең төмен және триацилглицеролдардың ең жоғары салыстырмалы құрамы бар (17-2 суретті қараңыз). Хломикрондар эпителий жасушаларының ішек бөлігінде синтезделеді, содан кейін лимфа жүйесі арқылы өтіп, сол жақ субклавиялық тамыр арқылы қанға енеді. Хиломикрон аполипопротеидтерінде апоБ-48 (липопротеиндердің осы класы үшін ерекше), apoE және apoC-II бар (21-2 кесте). AroC-II май тіндерінің, жүректің, қаңқа бұлшықетінің және лактация жасайтын сүт бездерінің капиллярларындағы липопротеидтік липазды белсендіреді, бұл тіндерге бос май қышқылдарының ағуын қамтамасыз етеді. Осылайша, хломикрондар май қышқылдарын ұлпаларға өткізеді, оларда отын ретінде сақталады немесе сақталады (Cурет 21-40). Хиломикронның қалдықтары (негізінен триацглицеролдардан босатылған, бірақ құрамында холестерин, apoE және apoB-48 бар) қан ағымы арқылы бауырға тасымалданады. Бауырда рецепторлар chylomicron қалдықтарындағы apoE-мен байланысады және олардың эндоцитоз арқылы сіңуіне ықпал етеді. Гепатоциттерде бұл қалдықтар құрамында холестеринді босатады және лизосомаларда жойылады.
21-2 кесте. Адамның плазмасындағы липопротеидтер аполипопротеидтері
Функция (егер белгілі болса)
L CAT іске қосады, ABC транспортерімен әрекеттеседі
L CAT тежейді
L CAT, холестеринді тасымалдау / тазартуды белсендіреді
LDL рецепторымен байланысады
Chylomicrons, VLDL, HDL
Chylomicrons, VLDL, HDL
Chylomicrons, VLDL, HDL
VLDL және chylomicron қалдықтарын тазарту басталады
Азық-түлік құрамында қазіргі кезде отын ретінде қолдануға болатын май қышқылдары көп болса, олар бауырдағы триацилглицеролдарға айналады, олар нақты аполипопротеидтермен фракцияны құрайды өте төмен тығыздықтағы липопротеидтер (VLDL). Бауырдағы артық көмірсулар триацилглицеролдарға айналады және VLDL түрінде экспортталады (21-40, а-сурет).Триацилглицеролдардан басқа, VLDL фракциясы құрамында холестерин мен холестеринді эфирлердің белгілі бір мөлшері, сонымен қатар apoB-100, apoC-1, apoC-II, apoC III және apoE бар (21-2 кесте). Бұл липопротеидтер сонымен бірге бауыр арқылы бұлшықет пен май тіндеріне қан арқылы тасымалданады, мұнда липопротеин липазын апо-С II белсендіргеннен кейін, VLDL фракциясының триацилглицеролдарынан бос май қышқылдары шығады. Адипоциттер бос май қышқылдарын ұстап, қайтадан оларды триацилглицеролдарға айналдырады, олар осы жасушаларда липидтік қосындылар (тамшылар), миоциттер түрінде сақталады, керісінше энергия алу үшін май қышқылдарын тез тотықтырады. VLDL қалдықтарының көпшілігі қан айналымынан гепатоциттермен шығарылады. Хломицрондардың сіңуіне ұқсас, олардың сіңуі рецепторлармен делдалданады және VLDL қалдықтарында апоЭ болуына байланысты (қосымша 21-2, apoE мен Альцгеймер ауруы арасындағы байланыс сипатталған).
Сур. 21-40. Липопротеидтер мен липидтер, және - липидтер қан айналымымен липопротеидтер түрінде тасымалданады, олар әр түрлі функциялары мен белоктар мен липидтердің әр түрлі құрамы бар бірнеше фракцияларға біріктіріледі (21-1, 21-2 кестелер) және осы фракциялар тығыздығына сәйкес келеді. Тағамдық липидтер хломицрондарға біріктірілген, олардың құрамындағы триацилглицеролдардың көп бөлігі липопротеин липазасы арқылы жабысқақ және бұлшықет тіндеріне капиллярларда шығарылады. Хиломикронның қалдықтары (құрамында ақуыз және холестерол бар) гепатоциттер арқылы жиналады. Бауырдан эндогендік липидтер мен холестерин майланған және бұлшықет тіндеріне VLDL түрінде жеткізіледі. Липидтердің VLDL-ден шығуы (кейбір аполипопротеидтердің жоғалуымен бірге) біртіндеп VLDLP-ны LDL-ге айналдырады, ол холестеринді экстафетикалық тіндерге жеткізеді немесе оны бауырға қайтарады. Бауыр VLDL, LDL және chylomicron қалдықтарын рецепторлармен өңделген эндоцитоз арқылы алады. Артық холестерин экстремальді тіндерде бауырға LDL түрінде тасымалданады. Бауырда холестериннің бір бөлігі өт тұздарына айналады. b - аштықтан кейін (сол жақта) және құрамында май мөлшері көп тамақ жегеннен кейін алынған қан плазмасының сынамалары (оң жақта). Майлы тамақты жегенде пайда болған хломицрондар плазмамен сүтке сыртқы ұқсастық береді.

Триацилглицеролдардың жоғалуымен VLDL бөлігі VLDL қалдықтарына айналады, сонымен қатар тығыздықты аралық липопротеидтер (VLDL) деп атайды, триацилглицеролдарды VLDL-ден әрі қарай алып тастауға мүмкіндік береді. төмен тығыздықтағы липопротеидтер (LDL) (21-1 кесте). LDL фракциясы холестеринге және холестеринді эфирлерге өте бай, сонымен қатар апоБ-100 де холестеринді плазма мембраналарында апоБ-100-ді танитын ерекше рецепторларды өткізетін экстефепатикалық тіндерге тасымалдайды. Бұл рецепторлар холестерин мен холестерин эфирлерін алуды қамтамасыз етеді (төменде сипатталғандай).
21-2 қосымша.ApoE аллельдері Альцгеймер ауруының таралуын анықтайды
Адам популяциясында аполипопротеин Е-ді кодтайтын геннің белгілі үш нұсқасы бар (үш аллель), apoE аллельдерінің ішінде APOEZ аллельдері адамдарда ең көп кездеседі (шамамен 78%), APOE4 және APOE2 аллельдері сәйкесінше 15 және 7% құрайды. APOE4 аллельдері әсіресе Альцгеймер ауруы бар адамдарға тән, сондықтан бұл байланыс аурудың пайда болу ықтималдығын алдын-ала болжауға мүмкіндік береді. APOE4 мұрасын алған адамдарда Альцгеймер ауруының кеш даму қаупі жоғары. APOE4 үшін гомозиготалы адамдарда аурудың дамуы 16 есе көп, ауыратындардың орташа жасы шамамен 70 жасты құрайды. AROEZ-нің екі көшірмесін иемденетін адамдар үшін, керісінше, Альцгеймер ауруының орташа жасы 90 жастан асады.
ApoE4 және Альцгеймер ауруы арасындағы байланыс үшін молекулалық негіз әлі белгісіз. Сонымен қатар, альцгеймер ауруының түпкі себебі болып табылатын apoE4 амилоидтық сымдардың өсуіне қалай әсер ететіні әлі белгісіз (4-31 суретті қара, 1-суретті қараңыз). Болжамдар нейрондардың цитоскелеттік құрылымын тұрақтандыруда apoE-нің мүмкін болатын рөліне назар аударады. ApoE2 және apoEZ белоктары нейрондардың микротубулаларына байланысты бірқатар ақуыздармен байланысады, ал apoE4 байланыспайды. Бұл нейрондардың өлімін тездетуі мүмкін. Бұл механизм қандай болмасын, бұл бақылаулар аполипопротеидтердің биологиялық функциялары туралы түсінігімізді кеңейтуге мүмкіндік береді.
Липопротеидтердің төртінші түрі - тығыздығы жоғары липопротеидтер (HDL), бұл фракция аз мөлшерде холестерині бар және толығымен холестеринді эфирлерден тұратын майда ақуызға бай бөлшектер түрінде бауырда және аш ішекте қалыптасады (21-40-сурет). HDL фракциясы құрамында apoA-I, apoC-I, apoC-II және басқа аполипопротеидтер бар (21-2 кесте), сонымен қатар лецитин-холестерин-ацилтрансфераза (LC AT), бұл лецитин (фосфатидилхолин) мен холестериннен холестерин эфирлерінің түзілуін катализдейді (21-41-сурет). Жаңадан пайда болған HDL бөлшектерінің бетіндегі L CAT хломицрон холестеринін және фосфатидилхолинді және VLDL қалдықтарын холестерин эфиріне айналдырады, олар ядро түзе бастайды, жаңа құрылған дисоидты HDL бөлшектерін жетілген сфералық HDL бөлшектеріне айналдырады. Бұл холестеринге бай липопротеин бауырға қайтарылады, онда холестерин «босатылады», холестериннің бір бөлігі өт тұздарына айналады.
Сур. 21-41. Лецитин-холестерин-ацилтрансфераза (L CAT) реакциясы катализденеді. Бұл фермент HDL бөлшектерінің бетінде болады және apoA-1 (HDL фракциясының құрамдас бөлігі) арқылы белсендіріледі. Холестерол эфирлері HDL бөлшектерінің ішінде жиналып, оларды жетілген HDL-ге айналдырады.

HDL бауырда рецепторлармен өңделген эндоцитоз арқылы сіңірілуі мүмкін, бірақ HDL холестеринінің бір бөлігі басқа тіндерге басқа тіндерге жеткізіледі. HDL бөлшектері бауыр жасушаларының плазмалық мембранасында және бүйрек үсті бездері сияқты стероидогенді тіндерде SR - BI рецепторлық ақуыздарымен байланысуы мүмкін. Бұл рецепторлар эндоцитозға әсер етпейді, бірақ холестеринді және HDL фракциясының басқа липидтерін жасушаға ішінара және таңдаулы түрде беру. HDL «таусылған» фракциясы қайтадан қанға енеді, мұнда липидтердің жаңа бөліктері chylomicron мен VLDL қалдықтарынан тұрады. Дәл сол HDL сонымен қатар экстафетикалық тіндерде сақталатын холестеринді ұстап, оны бауырға өткізе алады кері холестеринді тасымалдау (Cурет 21-40). Кері тасымалдаудың бір нұсқасында алынған HDL холестеринге бай жасушалардағы SR-BI рецепторларымен өзара әрекеттесуі холестеринді жасуша бетінен HDL бөлшектеріне пассивті диффузияны бастайды, содан кейін холестеринді бауырға қайтарады. Холестеринге бай жасушадағы кері тасымалдаудың басқа нұсқасында, HDL бөлінгеннен кейін, апоА-I белсенді тасымалдаушы, ABC ақуызымен әрекеттеседі. АпоА-I (және мүмкін HDL) эндоцитоз арқылы сіңіріледі, содан кейін қайтадан секрецияланып, холестеринмен бірге бауырға тасымалданады.
Протеин ABC1 көптеген дәрі-дәрмектерді тасымалдаушылардың үлкен тобының құрамына кіреді, кейде бұл тасымалдаушыларды АВС тасымалдаушылары деп атайды, өйткені олардың барлығында ATP байланыстыратын кассеталар (ATP - байланыстыратын кассеталар) болады, сонымен қатар алты трансмембраналық спиральдары бар екі трансмембраналық домен бар (тар. 11, 1-қ.). Бұл ақуыздар көптеген иондарды, аминқышқылдарын, дәрумендерді, стероидты гормондарды және өт тұздарын плазмалық мембраналар арқылы белсенді түрде тасымалдайды. Осы тасымалдаушылар отбасының тағы бір өкілі - CFTR ақуызы, ол кистозды фиброзбен зақымдалады (11-3, 1-т. Қара).
Холестеринді эфирлер жасушаға рецепторлық-эндоцитоз арқылы енеді
Қанның әр LDL бөлшегінің құрамында apoB-100 бар, ол белгілі бір беткі рецепторлық ақуыздармен танылады -LDL рецепторлары холестеринді ұстау керек жасушалардың мембранасында. LDL-нің LDL рецепторымен байланысуы эндоцитозды бастайды, соның салдарынан LDL және оның рецепторлары эндосома ішіндегі жасушаға өтеді (21-42-сурет). Эндосома ақырында цитозолға холестерин мен май қышқылдарын шығарып, холестерин эфирлерін гидролиздейтін ферменттері бар лизосомаға қосылады. LDL-ден алынған ApoB-100 сонымен бірге цитозолға секрецияланған аминқышқылдарын түзеді, бірақ LDL рецепторлары деградацияны болдырмайды және LDL қабылдауға қайтадан қатысу үшін жасуша бетіне оралады. ApoB-100 VLDL-де де бар, бірақ оның рецепторларды байланыстыратын домені LDL рецепторымен байланыса алмайды, VLDLP-ны LDL-ге түрлендіру рецептор-байланыстырушы доменді apoB-100-ге айналдырады. Бұл қандағы холестериннің тасымалдану жолын және оның мақсатты тіндердегі рецептормен қоздырылған эндоцитозын Майкл Браун мен Джозеф Голдштейн зерттеген.
Майкл Браун мен Джозеф Голдштейн

Сур. 21-42. Холестеринді рецепторлық-эндоцитоз арқылы алу.

Осылайша жасушаларға енетін холестеринді мембранаға қосуға немесе липидтер тамшыларының ішіндегі цитозолға сақтау үшін ACAT (21-38 сурет) арқылы қайта анықтауға болады. Қанның LDL фракциясында холестерин жеткілікті болған кезде, жасушаішілік холестериннің артық жиналуы оның синтезделу жылдамдығын төмендету арқылы алдын алады.
LDL рецепторы сонымен қатар apoE-мен байланысады және бауырмен хломицрондар мен VLDL қалдықтарын алу кезінде маңызды рөл атқарады. Алайда, егер LDL рецепторлары болмаса (мысалы, LDL рецепторлары генінің жетіспейтін тінтуірдің штаммында), VLDL қалдықтары мен хломицрондар әлі де бауыр арқылы сіңіріледі, бірақ LDL сіңірілмейді. Бұл VLDL мен chylomicron қалдықтарының рецепторлық орташаланған эндоцитозы үшін көмекші резервтік жүйенің болуын көрсетеді. Резервтік рецепторлардың бірі - apoE және басқа да бірқатар лигандалармен байланысатын липопротеинді рецепторларға байланысты LRP ақуызы (липопротеинді рецепторларға байланысты ақуыз).
Холестериннің биосинтезін реттейтін бірнеше деңгей
Холестерин синтезі күрделі және энергетикалық тұрғыдан қымбат процесс, сондықтан ағзаға тамақпен бірге оның мөлшерін толықтыратын холестерин биосинтезін реттеу тетігінің пайдалы екендігі түсінікті. Сүтқоректілерде холестерин өндірісі жасушаішілік концентрациямен реттеледі
холестерин және гормондар глюкагон мен инсулин. HMG - CoA-ны мевалонатқа айналдыру сатысы (21-34-сурет) холестерин түзудің метаболикалық жолындағы жылдамдықты шектейді (реттеудің негізгі нүктесі). Бұл реакция HMG - CoA редуктазасымен катализденеді. Холестерин деңгейінің өзгеруіне жауап ретінде HMG - CoA редуктазасын кодтайтын генге арналған транскрипциялық реттеудің тамаша жүйесі қолданылады. Бұл ген, холестеринді және қанықпаған май қышқылдарын сіңіруге және синтездеуге қатысатын 20-дан астам басқа ферменттермен бірге, ақуыз түзілуінің стеролды-реттегіш элементімен (SREBP, ақуыздарды байланыстыратын стеролды реттейтін элемент) өзара әрекеттесетін ақуыздар деп аталатын ақуыздардың шағын тобымен басқарылады. . Синтезден кейін бұл ақуыздар эндоплазмалық ретикулумға енеді. Жалғыз еритін SREBP амин терминалы доменінде сипатталған механизмдерді қолдана отырып, транскрипция активаторы ретінде қызмет етеді. 28 (3-қ.). Алайда, бұл домен ядроға қол жеткізе алмайды және SREBP молекуласында болған кезде геннің активтенуіне қатыса алмайды. HMG генінің - CoA редуктазасының және басқа гендердің транскрипциясын белсендіру үшін, транскриптикалық белсенді домен протеолитикалық бөліну арқылы SREBP қалған бөлігінен бөлінеді. Холестерин мөлшері жоғары болған кезде SREBP ақуыздары белсенді емес, ERAP-ке SCAP (SREBP - бөлінетін активтендіретін ақуыз) атты басқа ақуыз қосылған кешенде орнатылады (21-43-сурет). Холестеринді және басқа да бірқатар стеролдарды байланыстыратын SCAP - бұл стерол сенсоры. Стеролдың деңгейі жоғары болған кезде, SCAP - SREBP кешені басқа ақуызбен әрекеттесуі мүмкін, ол бүкіл кешенді ER-де сақтайды. Клеткадағы стеролдардың деңгейі төмендегенде, SCAP-тегі конформациялық өзгеріс сақтау белсенділігінің жоғалуына әкеледі, ал SCAP - SREBP кешені весикулалардың ішіне Гольджи кешеніне көшеді. Гольджи кешенінде SREBP ақуыздары екі түрлі протездермен екі рет бөлінеді, екінші бөліну цитозолға амин терминалы доменін шығарады. Бұл домен ядроға ауысады және мақсатты гендердің транскрипциясын белсендіреді. SREBP протеинінің амин терминалы қысқа жартылай шығарылу кезеңіне ие және протеасомалармен тез тозады (27-48, 3-суреттерді қараңыз). Стеролдың деңгейі жеткілікті түрде жоғарылаған кезде SR EBP ақуыздық домендерінің амин терминдерімен шығарылуы қайтадан бұғатталады, ал қолданыстағы белсенді домендердің протеазомалық деградациясы мақсатты гендердің тез тоқтап қалуына әкеледі.
Сур. 21-43. SR EBP активтендіру. SREB P ақуыздары стеролмен реттелетін элементпен (жасыл түс) синтезден кейін бірден ER-ға еніп, S CAP (қызыл түс) комплексін құрайды. (N және C белоктардың амин және карбоксил ұштарын білдіреді.) S-CAP байланыстырылған күйде SRE BP белоктары белсенді емес. Стерол деңгейі төмендеген кезде SR EBP-S CAP кешені Гольджи кешеніне көшеді, ал SR EBP ақуыздары екі түрлі протеазалармен жүйелі түрде бөлінеді. Шығарылған амин қышқылы терминалы SR EBP ақуыздық домені ядроға ауысады, онда стеролмен реттелетін гендердің транскрипциясын іске қосады.

Холестерин синтезін басқа да бірнеше механизмдер реттейді (21-44-сурет). Гормоналды бақылау NM G-CoA редуктазының коваленттік модификациясы арқылы жүзеге асырылады. Бұл фермент фосфорланған (белсенді емес) және депфосфорландырылған (белсенді) формаларда болады. Глюкагон ферменттің фосфорлануын (инактивациясын) ынталандырады, ал инсулин ферменттерді белсендіріп, холестерин синтезіне ықпал ететін депфосфорлануға ықпал етеді. Холестериннің жоғары жасушаішілік концентрациясы ASAT-ті белсенді етеді, бұл тұндыру үшін холестеринді эфирлеуді жоғарылатады. Сонымен, жасушалық холестериннің жоғары деңгейі LDL рецепторын кодтайтын геннің транскрипциясын тежейді, бұл рецептордың өндірілуін және, демек, қандағы холестериннің түсуін азайтады.
Сур. 21-44. Холестерин деңгейін реттеу синтез бен холестеринді тағамнан сіңіру арасындағы тепе-теңдікті қамтамасыз етеді. Глюкагон NM G -CoA редуктазасының фосфорлануын (инактивациясын) жеңілдетеді, инсулин депфосфорлануға (активтенуге) ықпал етеді. Х - NM G -CoA редуктазасының протеолизін ынталандыратын холестерин метаболиттері.

Реттелмейтін холестерин адамда ауыр ауруға әкелуі мүмкін. Тамақтан алынған синтезделген холестерин мен холестериннің жалпы мөлшері мембрананы жинауға, өт тұздары мен стероидтарды синтездеуге қажет мөлшерден асып кетсе, қан тамырларындағы холестериннің патологиялық жинақталуы (атеросклеротикалық бляшкалар) пайда болуы мүмкін, бұл олардың тоқтап қалуына (атеросклероз) әкелуі мүмкін. Индустриалды дамыған елдерде бұл өлім-жітімнің негізгі себебі болып табылатын коронарлық артериялардың тарылуына байланысты жүрек жеткіліксіздігі. Атеросклероздың дамуы қандағы холестериннің жоғары деңгейімен, әсіресе LDL фракциясымен берілетін холестериннің жоғары деңгейімен байланысты және HDL қанының жоғары деңгейі, керісінше, қан тамырларының жағдайына жағымды әсер етеді.
Тұқым қуалайтын гиперхолестеринемиямен (генетикалық ақау), қандағы холестерин деңгейі өте жоғары - бұл адамдарда бала кезінен-ақ ауыр атеросклероз дамиды. Ақаулы LDL рецепторына байланысты LDL холестеринінің рецепторлармен жеткіліксіз байланысы пайда болады. Нәтижесінде холестерин қаннан шығарылмайды, ол жинақталады және атеросклеротикалық бляшкалардың пайда болуына ықпал етеді. Эндогендік холестерин синтезі қандағы артық холестеринге қарамастан жалғасады, өйткені жасушадан тыс холестерол жасуша ішілік синтезді реттеуге клеткаға ене алмайды (21 -44-сурет).Тұқым қуалайтын гиперхолестеринемия және қан сарысуындағы холестериннің жоғарылауымен байланысты басқа ауруларды емдеу үшін статин кластары қолданылады. Олардың кейбіреулері табиғи көздерден алынады, ал кейбіреулері фармацевтика өнеркәсібімен синтезделеді. Статиндер мевалонатқа ұқсас (21-3 қосымшасы) және NMS-CoA редуктазасының бәсекеге қабілетті ингибиторлары болып табылады.
21-3-қосымша. МЕДИЦИНА. Липидтер гипотезасы және статиндердің құрылуы
Дамыған елдерде жүректің ишемиялық ауруы (ЖЖА) өлімнің негізгі себебі болып табылады. Жүрекке қан өткізетін коронарлық артериялардың тарылуы атеросклеротикалық бляшек деп аталатын майлы шөгінділердің пайда болуынан пайда болады, бұл плиталарда холестерин, фибриллалар белоктары, кальций, тромбоциттер және жасуша фрагменттері болады. ХХ ғасырда. Артериялық обструкция (атеросклероз) мен қандағы холестерин арасындағы байланыс туралы белсенді пікірталастар болды. Осы пікірталастар мен осы бағыттағы белсенді зерттеулер холестеринді төмендететін тиімді дәрілердің пайда болуына әкелді.
1913 жылы белгілі орыс ғалымы және эксперименталды патология саласындағы маман Н.Н.Аничков «Холестеринге бай тағаммен қоректенетін қояндардың қарттардың тамырларындағы атеросклеротикалық бляшектерге ұқсайтын қан тамырларына зақым келтіретінін көрсетті» атты еңбегін жариялады. Аничков бірнеше онжылдық бойы өз зерттеулерін жүргізді және нәтижелерін әйгілі батыс журналдарында жариялады. Өкінішке орай, оның мәліметтері адамдарда атеросклерозды дамыту үшін үлгі бола алмады, өйткені сол кезде бұл ауру қартаюдың табиғи нәтижесі болып табылады және оны болдырмау мүмкін емес деген болжам басым болды. Алайда, дәлелдемелер біртіндеп қан сарысуындағы холестерин мен атеросклероздың дамуы (липидті гипотеза) арасындағы байланысты жинақтады және 1960 ж. кейбір зерттеушілер бұл ауруды дәрі-дәрмектермен емдеуге болатындығын нақты мәлімдеді. Алайда, 1984 жылы АҚШ-тың Ұлттық денсаулық сақтау институты жүргізген холестериннің рөлін кеңінен зерттеу нәтижелері жарияланғанға дейін (коронарлық алғашқы профилактика сынағы) қарама-қарсы көзқарас қалыптасты. Миокард инфарктісінің және қан холестеринінің төмендеуімен соққылардың статистикалық маңызды төмендеуі көрсетілген. Бұл зерттеуде холестеринді төмендету үшін холестерин, өт қышқылдарын байланыстыратын анион алмасу шайыры қолданылды. Нәтижелер жаңа, неғұрлым күшті терапевтік препараттарды іздеуді ынталандырды. Айту керек, ғылыми әлемде липидтік гипотезаның негізділігі туралы күмәндер тек 1980 жылдардың аяғы - 1990 жылдардың басында статиндердің пайда болуымен ғана жойылды.
Алғашқы статинді Токиодағы Санкёда Акира Эндо ашқан. Эндо өз жұмысын 1976 жылы жариялады, дегенмен ол бірнеше жыл бойы холестерин алмасуының проблемасымен айналысты. 1971 жылы ол холестерин синтезінің ингибиторларын сол кезде зерттелген антибиотиктердің саңырауқұлақ өндірушілерінде де болуы мүмкін деп ұсынды. Бірнеше жылдық қарқынды жұмыс барысында ол оң нәтижеге жеткенше әртүрлі саңырауқұлақтардың 6000-нан астам мәдениетін талдады. Алынған қосылыс компактин деп аталды. Бұл зат иттер мен маймылдардағы холестеринді төмендеткен. Бұл зерттеулер Майкл Браун мен Джозеф Голдштейннің назарын Техас университетінің оңтүстік-батыс медициналық мектебіне аударды. Браун мен Голдштейн Эндо бірге бірлесіп зерттеу жүргізіп, оның мәліметтерін растады. Алғашқы клиникалық зерттеулердің басты жетістіктері фармацевтикалық компаниялардың осы жаңа препараттарды әзірлеуге қатысуы болды. Меркте Альфред Альберт пен Рой Вагелос бастаған топ саңырауқұлақ дақылдарының жаңа скринингін өткізіп, 18 мәдениеттің жалпы талдауы нәтижесінде тағы бір белсенді дәріні тапты. Жаңа зат ловастатин деп аталады. Алайда, сонымен бірге, компактиннің жоғары дозаларын иттерге қабылдау 1980 жылдары қатерлі ісік ауруына және жаңа статиндерді іздеуге әкеледі деген пікір кеңінен айтылды. тоқтатылды. Алайда, осы уақытқа дейін отбасылық гиперхолестеринемиямен ауыратын науқастарды емдеу үшін статиндерді қолданудың пайдасы айқын болды. Халықаралық сарапшылармен және азық-түлік және дәрі-дәрмектермен (FDA, АҚШ) көптеген консультациялардан кейін Мерк ловастатинді дамыта бастады. Келесі екі онжылдықта жүргізілген кеңейтілген зерттеулер ловастатиннің канцерогендік әсерін және одан кейін пайда болған жаңа дәрілік заттарды анықтаған жоқ.
Сур. 1. Статиндер NM G-CoA редуктазасының ингибиторлары болып табылады. NM G -CoA редуктазасының әсерін тежейтін мевалонат пен төрт фармацевтикалық өнімнің (статиндердің) құрылымын салыстыру.

Статиндер HMG - CoA - редуктазаның әсерін тежейді, мевалонат құрылымын еліктейді және осылайша холестерин синтезін тежейді. LDL рецепторлары генінің бір данасында ақауы бар гиперхолестеринемиямен ауыратын науқастарда ловастатин қабылдаған кезде холестерин деңгейі 30% төмендейді. Препарат өт қышқылдарын байланыстыратын және олардың ішектен кері сіңуіне жол бермейтін арнайы шайырлармен үйлескенде одан да тиімді.
Қазіргі уақытта статиндер қан плазмасындағы холестеринді төмендету үшін жиі қолданылады. Кез-келген дәрі қабылдаған кезде олардың жағымсыз жанама әсерлері туралы сұрақ туындайды. Алайда статиндер жағдайында көптеген жанама әсерлер, керісінше, оң болады. Бұл препараттар қан ағымын ынталандырады, бұрыннан бар атеросклеротикалық бляшектерді бекітеді (қан тамырларының қабырғаларынан шығып кетпеуі және қан ағымына кедергі жасамауы үшін), тромбоциттер агрегациясын тежейді, сондай-ақ қан тамырлары қабырғаларында қабыну процестерін әлсіретеді. Алғаш рет статиндерді қабылдаған пациенттерде бұл әсерлер холестерин деңгейі төмендей бастағанға дейін көрінеді және мүмкін изопреноид синтезін тежеумен байланысты. Әрине, статиндердің кез келген жанама әсері пайдалы емес. Кейбір науқастарда (әдетте статинді холестеринді төмендететін басқа препараттармен бірге қабылдаған емделушілердің арасында) бұлшықет ауруы және бұлшықет әлсіздігі, кейде айтарлықтай күшті күйде болуы мүмкін. Сонымен қатар статиндердің басқа да көптеген жанама әсерлері тіркелген, олар, сирек кездеседі. Науқастардың басым көпшілігінде статиндерді қабылдау жүрек-тамыр ауруларының дамуына кедергі келтіруі мүмкін. Кез-келген басқа дәрі сияқты, статиндер тек дәрігердің нұсқауы бойынша қолданылуы керек.

HDL холестеринінің тұқым қуалайтын болмауында холестерин деңгейі өте төмен, Танжер ауруы кезінде холестерин іс жүзінде анықталмайды. Екі генетикалық бұзылыс ABC1 ақуызындағы мутация нәтижесінде пайда болады. HDL-холестерин фракциясы ABC1 жетіспейтін жасушалардан холестеринді ала алмайды, ал холестеролды сарқылған жасушалар қаннан тез шығарылып, жойылады. HDL-дің тұқым қуалайтын болмауы да, Танжер ауруы да өте сирек кездеседі (Танжер ауруы бар 100-ден кем отбасы бүкіл әлемге белгілі), бірақ бұл аурулар HDL плазмасының деңгейін реттеуде ABC1 ақуызының рөлін көрсетеді. Төмен плазмалық HDL деңгейі коронарлық артериялардың зақымдануының жоғары деңгейімен байланысты болғандықтан, ABC1 ақуызы HDL деңгейін реттеуге арналған дәрі-дәрмектерге пайдалы болуы мүмкін. ■
Стероидты гормондар холестерин мен оның тотығуының бүйір тізбегін бөлу арқылы түзіледі.
Адам барлық стероидты гормондарды холестериннен алады (21-45-сурет). Бүйрек үсті қыртысында стероидты гормондардың екі класы синтезделеді: минерортикоидтар,органикалық емес иондардың (Na +, C l - және HC O) сіңірілуін реттейді 3 -) бүйректе, және глюкокортикоидтар, бұл глюконеогенезді реттеуге және қабыну реакциясын төмендетуге көмектеседі. Жыныстық гормондар ерлер мен әйелдердің репродуктивті жасушаларында және плацентада шығарылады. Олардың ішінде прогестерон ұрпақты болу циклін реттейтін, андрогендер (мысалы, тестостерон) және эстрогендер сәйкесінше ерлер мен әйелдерде екіншілік жыныстық сипаттамалардың дамуына әсер ететін (эстрадиол). Стероидты гормондар өте төмен концентрацияларда әсер етеді, сондықтан салыстырмалы түрде аз мөлшерде синтезделеді. Өт тұздарымен салыстырғанда стероидты гормондарды өндіру үшін аз мөлшерде холестерин жұмсалады.

Сур. 21-45. Кейбір стероидты гормондар холестериннен түзіледі. Осы қосылыстардың кейбіреулерінің құрылымы күріш. 10-19, 1-т.

Стероидты гормондардың синтезі холестериннің С-17 D-сақинасының «бүйір тізбегінде» бірнеше немесе барлық көміртек атомдарын жоюды талап етеді. Бүйір тізбегін алып тастау стероидогенді тіндердің митохондриясында болады. Шығару процесі бүйір тізбектің екі көршілес көміртек атомдарының гидроксилденуінен (С-20 және С-22), содан кейін олардың арасындағы байланыстың бөлінуінен тұрады (21-46-сурет). Әртүрлі гормондардың түзілуіне оттегі атомдарының енгізілуі де кіреді. Стероидті биосинтез кезіндегі барлық гидроксилдену және тотығу реакциялары NA D PH, O пайдаланатын аралас функционалды оксидазалармен катализденеді (21-1 қосымшасы). 2 және P-450 митохондриялық цитохромы.
Сур. 21-46. Стероидты гормондардың синтезіндегі бүйір тізбектің бөлінуі. Көршілес көміртек атомдарын тотықтыратын аралас функциясы бар осы оксида жүйесінде Р-450 цитохромы электронды тасымалдаушы рөлін атқарады. Процесске электрон тасымалдайтын ақуыздар, адренодоксин және адренодоксин редуктазы қатысады. Бүйір тізбегін бөлудің бұл жүйесі бүйрек үсті безінің митохондриясында табылды, онда стероидтердің белсенді өндірісі жүреді. Прегенненолон - бұл барлық басқа стероидты гормондарға алдын-ала әсер етуші құрал (21-45-сурет).

Холестерин биосинтезінің делдалдары көптеген басқа метаболикалық жолдарға қатысады.
Холестерин биосинтезінің аралық рөлінен басқа, изопентенил пирофосфаты әртүрлі биологиялық функцияларды орындайтын көптеген биомолекулалардың синтезделуінде белсендірілген прекурсор ретінде қызмет етеді (21-47-сурет). Оларға А, Е және К витаминдері, каротин және хлорофилл фитол тізбегі сияқты өсімдік пигменттері, табиғи резеңке, көптеген эфир майлары (мысалы, лимон майының хош иісті негізі, эвкалипт, мускус), метаморфозды реттейтін жасөспірімдер гормоны, долихолдар жатады. Полисахаридтерді, убикинонды және пластокинонды - митохондриядағы және хлоропластардағы электронды тасымалдаушыларды күрделі синтезде липидті еритін тасымалдаушы ретінде қызмет етеді. Барлық осы молекулалар құрылымдағы изопреноидтар болып табылады. Табиғатта 20 000-нан астам әртүрлі изопреноидтар табылды және жыл сайын жүздеген жаңа жаңалықтар пайда болады.
Сур. 21-47. Изопреноидтардың биосинтезінің жалпы көрінісі. Мұнда ұсынылған көптеген дайын өнімдердің құрылымы тарауда келтірілген. 10 (1-қ.).

Прениляция (изопреноидтың ковалентті қосылуы, 27-35 суретті қараңыз) - ақуыздарды аналық сүтқоректілердің жасуша мембраналарының ішкі бетіне бекітетін жалпы механизм (11-14 суретті қараңыз). Кейбір ақуыздарда байланысқан липид 15 көміртекті фарнезил тобымен ұсынылған, басқаларында бұл 20 көміртекті геранил геранил тобы. Липидтердің бұл екі түрі әртүрлі ферменттерді байланыстырады. Прениляция реакциясы ақуыздарды липидтің қандай байланысқанына байланысты әртүрлі мембраналарға бағыттайды. Ақуыздың құрамы изопрен туындылары үшін маңызды рөл атқарады - холестерин метаболизмі жолдарының қатысушылары.
21.4-бөлімнің қысқаша мазмұны Холестериннің, стероидтардың және изопреноидтардың биосинтезі
■ Холестерин ацетил-КоА-дан reaction-гидрокси-β-метилглютарил-КоА, мевалонат, екі белсенді изопрен диметиллалил пирофосфаты және изопентенил пирофосфаты сияқты аралықтар арқылы күрделі реакция тізбегінде түзіледі. Изопрен қондырғыларының конденсациясы циклден тыс сақиналы жүйені және стероидты бүйір тізбегін құруға цикл беретін циклдік емес скалалинді береді.
■ Холестерин синтезі гормоналды бақылауда және коваленттік модификация мен транскрипцияны реттеу нәтижесінде болатын жасушаішілік холестерин концентрациясының жоғарылауына кедергі келтіреді.
■ Холестерин мен холестеринді эфирлерді қан плазмалық липопротеидтер ретінде алады. VLDL фракциясы холестеринді, холестеринді эфирлерді және триацилглицеролдарды бауырдан басқа тіндерге тасымалдайды, мұнда триацилглицеролдар липопротеин липазасымен жабылады және VLDL LDL-ге айналады. Холестерин мен холестерин эфирлерімен байытылған LDL фракциясы жанама түрде рецепторларды эндоцитоз арқылы алады, ал LDL құрамындағы B-100 аполипопротеинін плазмалық мембрана рецепторлары таниды. HDL қандағы холестеринді алып тастайды, оны бауырға береді. Тамақтану жағдайлары немесе холестерин алмасуындағы генетикалық ақаулар атеросклерозға және миокард инфарктісіне әкелуі мүмкін.
■ Стероидты гормондар (глюкокортикоидтар, минерокортикоидтар және жыныстық гормондар) холестериннен бүйір тізбегін өзгерту және оттегі атомдарын сақинаның стероидтық жүйесіне енгізу арқылы түзіледі. Көптеген басқа изопреноидты қосылыстар холестеринмен бірге изопентенил пирофосфаты мен диметиллалл пирофосфатын конденсациялау арқылы мевалонатадан шығарылады.
■ Белгілі бір ақуыздардың алдын-алу оларды жасуша мембраналарымен байланыстыратын жерлерге бағыттайды және олардың биологиялық белсенділігі үшін маңызды.
48 сұрақ. Жоғары май қышқылдарының метаболизмін реттеу (β-тотығу және биосинтез). Малонилді КоА синтезі. Ацетил КоА карбоксилазы, оның қызметін реттеу. Ко-а ацилінің митохондрияның ішкі мембранасы арқылы тасымалдануы.
Негізгі
фенилаланин мөлшері тұтынылады
2 тәсілмен:
қосылады
сарайларда,
бұрылады
тирозинде.
Бұру
ең алдымен тирозинге фенилаланин
артық мөлшерін алып тастау үшін қажет
фенилаланин, өйткені жоғары концентрацияда
Оның жасушаларға улы. Білім
тирозиннің маңызы жоқ
өйткені бұл амин қышқылының жетіспеушілігі
жасушаларда іс жүзінде болмайды.
Негізгі
фенилаланин метаболизмі басталады
оның гидроксилденуімен (9-29 сурет),
нәтижесінде тирозин пайда болады.
Бұл реакция белгілі бір затпен катализденеді
монокси-насе - фенилаланин гидраты (зсилаза,
ол бірлесіп өндіруші ретінде қызмет етеді
тетрагидробиоптерин (N4BP).
Ферменттің белсенділігі де байланысты
Fe2-нің болуы.
Ішінде
бауыр ең алдымен жеделдетілген жұмылдыру
гликоген (7 бөлімін қараңыз). Алайда акциялар
Бауырдағы гликоген таусылып қалады
18-24 сағаттық ораза. Негізгі көзі
глюкоза, өйткені қорлар таусылып қалады
гликоген глюконеогенезге айналады,
ол тездете бастайды
Сур.
11-29. Негізгі метаболикалық өзгерістер
абсорбентті өзгерткен кездегі энергия
постабсорбциялық күй. КТ
- кетон денелері, FA - май қышқылдары.
4-6 сағ
соңғы тамақтан кейін. Субстраттар
глицерин глюкоза синтезі үшін қолданылады,
аминқышқылдары және лактат. Жоғарыда
глюкагон концентрациясының синтезделу жылдамдығы
байланысты май қышқылдары азаяды
фосфорлану және инактивация
ацетил КоА карбоксилазы және жылдамдығы
р-тотығу жоғарылайды. Сонымен бірге
бауырға майдың көбеюі
тасымалданатын қышқылдар
май қоймаларынан. Ацетил-КоА түзілді
май қышқылдарының тотығуында ол қолданылады
бауырда кетон денелерін синтездеуге арналған.
Ішінде
концентрациясының жоғарылауымен май тіндері
глюкагон синтездеу жылдамдығын төмендетеді
TAG және липолиз қозғалады. Ынталандыру
липолиз - активтендіру нәтижесі
гормонға сезімтал TAG липазасы
глюкагонның әсерінен адипоциттер.
Майлы қышқылдар маңызды болады
бауырдағы, бұлшық еттердегі энергия көздері
май тіндері.
Сонымен
осылайша, постабсорбция кезеңінде
қандағы глюкозаның концентрациясы сақталады
80-100 мг / дл, май деңгейінде
қышқылдар мен кетон денелері көбейеді.
Қант
қант диабеті - бұл ауру
абсолютті немесе туыстық байланысты
инсулин тапшылығы.
Ә.
Қанттың негізгі клиникалық формалары
қант диабеті
Сәйкес
Дүниежүзілік ұйым
денсаулық сақтау қант диабеті
айырмашылықтарға сәйкес жіктеледі
генетикалық факторлар және клиникалық
екі негізгі формасы: қант диабеті
I тип - инсулинге тәуелді (IDDM) және қант диабеті
II тип - инсулинге тәуелсіз (NIDDM).
Реттеу
реттейтін фермент синтезі
lcd - ацетил КоА карбоксилазын синтездеу.
Бұл фермент бірнеше реттеледі
жолдары.
Белсендіру / бөлу
ферментті субтониттік кешендер. Ішінде
ацетил КоА карбоксилазасының белсенді емес формасы
жекелеген кешендерді білдіреді,
олардың әрқайсысы 4 бөлімнен тұрады.
Ферменттің активаторы - цитрат. Бұл ынталандырады
кешендердің комбинациясы, нәтижесінде
бұл арқылы ферменттің белсенділігі артады
. Ингибитор-пальмитойл-КоА. Қоңырау шалады
күрделі диссоциация және төмендеу
ферменттің белсенділігі.
Фосфорлану / Депфосфорлану
ацетил КоА карбоксилазы. Ішінде
постабсорбциялық күй немесе
физикалық жұмыс глюкагонизацияланған
адреналин аденилат цикласы арқылы
жүйе прокиназа А және активтендіріледі
субофиттік фосфорлануды ынталандыру
ацетил КоА карбоксилазы. Фосфорланған
фермент белсенді емес және майлы синтез
қышқылдар тоқтайды.
Сіңіргіш
инсулин кезеңі фосфатазаны белсендіреді,
ацетил-КоА карбоксилазы кіреді
депфосфорланған күй. Содан кейін
цитраттың әсерінен пайда болады
фермент протеиндерінің полимерленуі, және
ол белсенді бола бастайды. Іске қосудан басқа
фермент, цитрат басқасын орындайды
СКД синтезіндегі функция. Сіңіргіш
бауыр жасушаларының митохондриясындағы кезең
цитрат жинайды, оның ішінде
ацилдің қалдығы тасымалданады
цитозол.
Реттеу
β-тотығу жылдамдығы.
Β-тотығу-метаболизм жолы,
CPE және жалпы жұмысымен тығыз байланысты
катаболизм жолдары. Сондықтан оның жылдамдығы
жасуша қажеттілігімен реттеледі
энергия ATP / ADP және NADH / NAD коэффициенттері бойынша, сонымен қатар реакция жылдамдығы CPE және
катаболизмнің жалпы жолы. Жылдамдық
Тіндердегі β-тотығу қол жетімділігіне байланысты
субстрат, яғни
май мөлшері туралы
митохондрияға енетін қышқылдар.
Тегін май қышқылдарының концентрациясы
белсендіру кезінде қанда жоғарылайды
ораза кезінде май тініндегі липолиз
глюкагонның әсерінен және физикалық кезінде
адреналиннің әсерінен жұмыс жасау. Бұларда
май қышқылдары болады
басым энергия көзі
нәтижесінде бұлшықеттер мен бауыр үшін
β-тотығу NADH және ацетил-КоА ингибирлеуімен түзіледі
пируватты дегидрогеназа кешені.
Пируватты түзудің трансформациясы
глюкозадан ацетил-КоА-ға дейін баяулайды.
Аралық метаболиттер жинақталады
гликолиз және, атап айтқанда, глюкоза-6-фосфат.
Глюкоза-6-фосфат гексокиназды тежейді
және демек, ұнжырғасы түседі
процесте глюкозаны қолдану
гликолиз. Осылайша, басым
негізгі көзі ретінде LCD пайдалану
бұлшықет тініндегі және бауырдағы энергия
жүйке тініне глюкозаны үнемдейді және
эритроциттер.
Β-тотығу жылдамдығы
ферменттің белсенділігіне байланысты
карнитин ацилтрансферазалары I.
Бауырда бұл фермент ингибирленген.
пайда болған малонил КоА
lcd биосинтезімен Сіңіру кезеңінде
гликолиз бауырда белсендіріледі және
ацетил-КоА түзілуі артады
пируваттан. Бірінші синтез реакциясы
ацетил-КоА-ны малонил-КоА-ға айналдыру.
Малонил-КоА сұйықтықтың cd-тотығуын тежейді,
оны синтездеуге қолдануға болады
май.
Білім
ацетил-КоА-реттегішінен алынған малонил-КоА
биосинтездегі реакция LCD. Бірінші реакция
ацетил-КоА-ның лДК-ны синтездеу
малонил КоА. Каталитикалық фермент
бұл реакция (ацетил Коа карбоксилазы),
лигалар класына жатады. Оның құрамында
ковалентті байланысқан биотин. Біріншісінде
co2 ковалентті реакция сатылары
энергияға байланысты биотинмен байланысады
АТФ, екінші сатыда COO - ауыстырылды
ацетил-КоА-да малонил-КоА түзеді.
Ацетил КоА карбоксилаза ферментінің белсенділігі
кейінгі барлық жылдамдықты анықтайды
синтез реакциялары lc
цитрат цитозолдағы ферментті белсендіреді
ацетил КоА карбоксилазы. Малонил CoA in
өз кезегінде жоғары деңгейдің ауысуына кедергі келтіреді
май қышқылдары цитозолдан матрицаға дейін
белсенділікті тежейтін митохондрия
сыртқы ацетил Коа: карнитин ацилтрансфераза,
жоғары тотығуды тоқтатады
май қышқылдары.
Ацетил-КоА оксалоацетаты →
HS-CoA цитраты

HSCOA ATP Цитраты → Ацетил-КоА ADP Pi Oxaloacetate
Ацетил-КоА
цитоплазмада бастапқы субстрат ретінде қызмет етеді
LCD және оксалоацетатты синтездеуге арналған
цитозол өзгеріске ұшырайды
нәтижесінде пируват пайда болады.
Холестерин биосинтезі
Холестерин биосинтезі эндоплазмалық ретикулумда жүреді. Молекуладағы барлық көміртек атомдарының көзі митохондриядан митохондриядан, майлы қышқылдар синтезінде болатын ацетил-SCoA болып табылады. Холестерин биосинтезі 18 ATP молекуласын және 13 NADPH молекуласын тұтынады.
Холестериннің пайда болуы 30-дан астам реакцияда жүреді, оларды бірнеше сатыға топтастыруға болады.
1. Мевальон қышқылының синтезі.
Алғашқы екі синтез реакциясы кетогенез реакцияларымен сәйкес келеді, бірақ 3-гидрокси-3-метилглютарил-ScoA синтезінен кейін фермент енеді гидроксиметил-глютарил-ScoA редуктазы (HMG-SCOA редуктаза), мевалон қышқылын түзеді.
 |